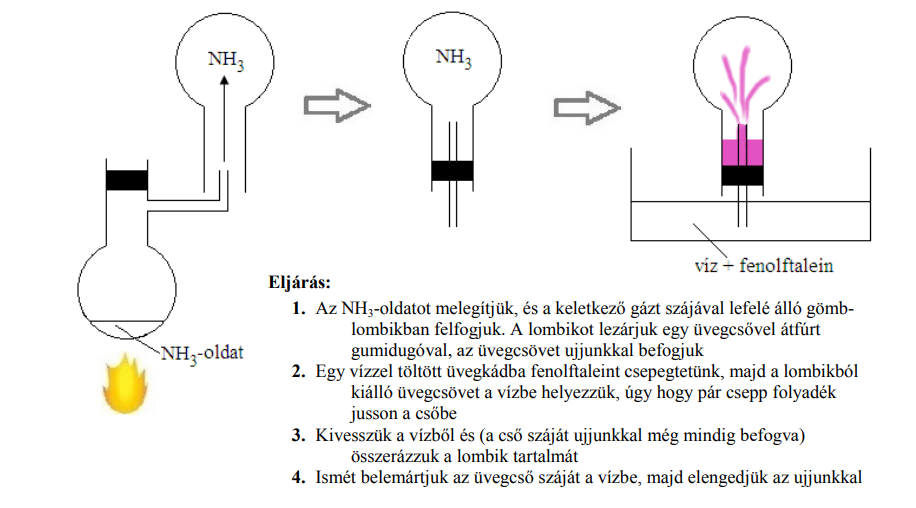
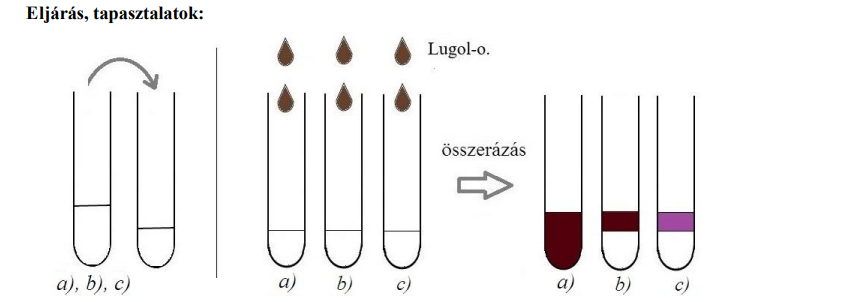
FELADAT/KIVITELEZÉS:
“Két kémcső közül az egyikbe rétegezzen egymásra egyujjnyi desztillált vizet és egyujjnyi
benzint, a másikba szintén egyujjnyi vizet és egyujjnyi étert! Rázza össze a kémcsövek
tartalmát, figyelje meg, mi történik! Tegyen mind a két kémcsőbe kanálhegynyi
jódkristályt! Rázza össze a kémcsövek tartalmát! Figyelje a változást, majd öntse össze
a két kémcső tartalmát, és rázza össze az elegyet! Magyarázza meg a látottakat!
A kísérletek alapján hasonlítsa össze a víz sűrűségét a benzin és az éter sűrűségével!”
Forrás: https://dload-oktatas.educatio.hu/erettsegi/nyilvanos_anyagok_2018tavasz/kemia_emelt_szob_kiserlet_b_2018maj.pdf
A kísérlet tapasztalatai
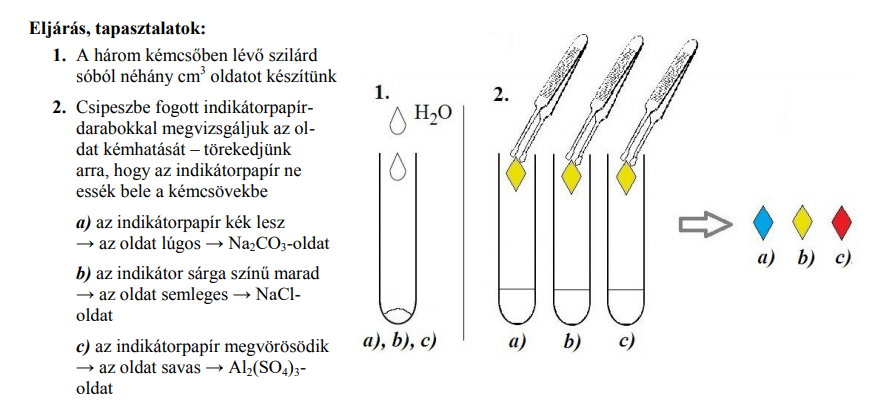
a)
A víz és benzin összekeverése, majd jód hozzáadása után azt tapasztaljuk, hogy:
-a két fázis elkülönül egymástól, mert a víz poláris, a benzin apoláris, nem oldódnak egymásban, a benzin kisebb sűrűségű, ezért felül helyezkedik el.
-a jód apoláris,lila színnel oldódik a benzinben, összerázás után a szín a felső fázisban jelenik meg, a vizes fázisban esetleg gyenge sárga szín jelentkezik, a rosszul oldódó jód miatt.
b)
A víz és éter :
-A két fázis elkülönül egymástól, mert a víz poláris, az éter apoláris, nem oldódnak egymásban, az éter kisebb sűrűségű, ezért felül helyezkedik el.
-A jód apoláris, az éter oxigéntartama miatt barnás – vöröses színnel oldódik az éterben, összerázás után a szín a felső fázisban jelenik meg, a vizes fázisban esetleg gyenge sárga szín jelentkezik, a rosszul oldódó jód miatt.
c)
Összeöntve:
-a két kémcső tartamát, a színes, apoláris fázisok elegyednek, de a víz továbbra is az alsó fázisban marad, elkülönülve, gyenge sárgára színeződve.
d)
Sűrűség szerint sorba rendezve:
Éter,benzin,víz.
e)
További magyarázat:
-A víz poláris anyag, a benzin, a jód és az éter apoláris.
-Oxigénmentes oldószerben a jód lila, oxigéntartalmúban barna színnel oldódik.