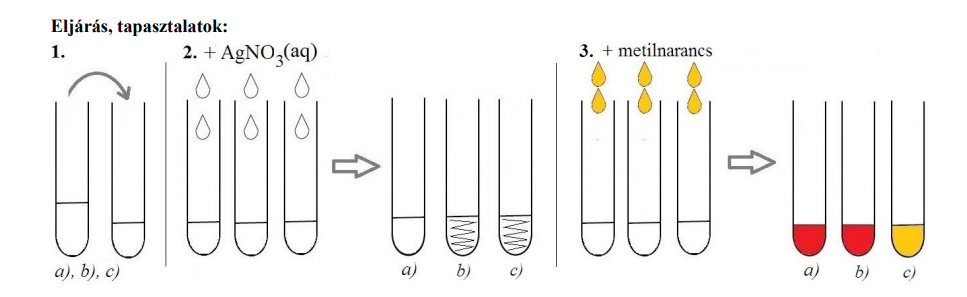
Megfelezzük a kémcsövek tartalmát
Az egyik sorozathoz ezüst-nitrát-oldatot cseppentünk
→ az egyik esetben nem történik semmi, két esetben fehér csapadék képződik
A másik sorozathoz metilnarancs indikátort adunk
→ az egyik esetben az indikátor sárga színű marad, két esetben vörös lesz
Tehát:
a) ezüst-nitrát-oldattal nem ad csapadékot, az indikátort vörösre színezi → HNO3
b) ezüst-nitrát-oldattal csapadékot ad, az indikátort vörösre színezi → HCl
c) ezüst-nitrát-oldattal csapadékot ad, az indikátor színét nem változtatja meg → NaCl
Magyarázat:
2. Az Ag+az oldatban lévő Cl–-ionokat mutatja ki: az AgCl fehér csapadék – szerkezete (ionos / kovalens)
átmeneti kötései miatt az ionrács és az atomrács közötti átmenet, ezért nem oldódik vízben
Ag++ Cl–= AgCl (AgNO3 + HCl = AgCl + HNO3)
(AgNO3 + NaCl = AgCl + NaNO3)
az ionegyenlet kifejezőbb, mint a bruttó
3. A metilnarancs indikátorként savas közegben vörös, semleges és lúgos közegben sárga színű
HCl + H2O → H3O++ Cl–
HNO3 + H2O → H3O++ NO3–
Fogalmak:
csapadék: egy reakció során frissen képződő, az adott oldószerben nem oldódó, onnét szilárd formában
kiváló anyag
indikátor: olyan anyag, mely színváltozásával jelzi a kémhatást (sav-bázis indikátor). Tágabb szóhasználatban valamilyen anyag jelenlétét színváltozással kimutató anyag
kémhatás: oldatok jellemzője, elárulja, hogy az H3O+-ionok vagy a OH–-ionok koncentrációja nagyobb-e.
Savas kémhatás: c(H3O+) > c(OH–), semleges: c(H3O+) = c(OH–), lúgos: c(OH–) > c(H3O+)
sav (Arrhenius): olyan anyag, amely vízben oldódva disszociáció révén növeli a H+-koncentrációt(Brönsted): H+/ p+leadására képes részecske bruttó (sztöchiometriai) egyenlet: olyan reakcióegyenlet, melyben a részt vevő anyagok teljes képletükkel szerepelnek
ionegyenlet: olyan reakcióegyenlet, melyben csak a változást szenvedő részecskéket tüntetjük fölmindkettő erős sav, az oldatban teljes mértékben disszociál.


Kommentek
Kommenteléshez kérlek, jelentkezz be: