FORRÁS: kiserletek_emelt_erettsegi.pdf (fazekas.hu)
Magyarázat:
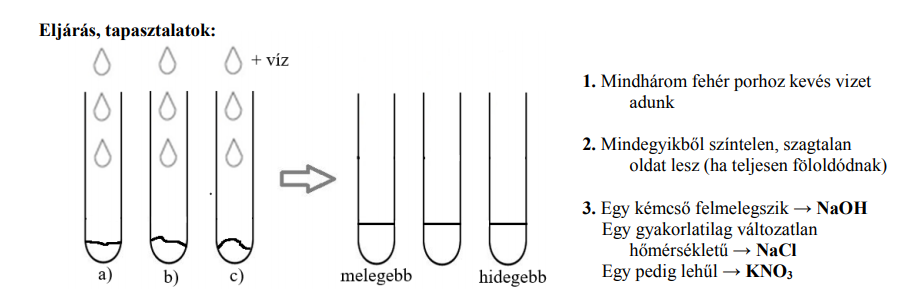
Mindhárom vegyület ionrácsos, vízben oldódó anyag
NaOH(sz) → Na+(aq) + OH–(aq) Qold(NaOH) = –42 kJ/mol
NaCl(sz) → Na+(aq) + Cl–(aq) Qold(NaCl) = +4 kJ/mol
KNO3(sz) → K+(aq) + NO3– (aq) Qold(KNO3) = +35 kJ/mol
Oldódásuk során az ionrácsnak szét kell esnie, föl kell bomlania az ionkötésnek
→ ehhez energiára van szükség, ez a rácsenergia
Ezzel egyidejűleg a létrejövő szabad ionok körül hidrátburok képződik, ez a folyamat a hidratáció
→ a másodrendű (ion-dipólus) kötések kialakulásával energia szabadul fel, ez a hidratációs energia
A rácsenergia endoterm, a hidratáció exoterm folyamat. Az összérték, az oldáshő e két tényezőtől függ:
Qold = Erács + ΣEhidr
→ A NaOH rácsenergiájának nagysága kisebb ionjai hidratációs energiái összegének abszolút
értékénél, azaz az oldáshő negatív / exoterm
→ A NaClrácsenergiája összemérhető a hidratációs energiák összegének abszolút értékével (kicsit
nagyobb), azaz az oldáshő gyakorlatilag autoterm (elvileg kissé pozitív / endoterm)
→ A KNO3 rácsenergiájának nagysága nagyobb ionjai hidratációs energiái összegének abszolút
értékénél, tehát az oldáshő pozitív / endoterm


Kommentek
Kommenteléshez kérlek, jelentkezz be: